Молекулярная динамика белков и пептидов
Методическое пособие
3.3. Изучение динамики модифицированного полипептида СЕМАКС-05. Пример отчёта.
Целью задачи было проанализировать динамическое поведение модифицированного пептида Семакс05.
Исходная структура пептида: Met Glu His Phe Pro Gly Pro.
Модифицированная структура: Met Asp His Phe Pro Gly Pro.
Пептид Семакс является ноотропным веществом, улучшающим память, умственные способности, как при нормальном состоянии, так и при нервно-дегенеративных заболеваниях.
Метод молекулярной динамики позволяет моделировать детальную микроскопическую картину внутренней подвижности макромолекулы. В методе молекулярной динамики рассчитываются классические (ньютоновские) траектории движения макромолекулы в силовом поле эмпирического атом-атомного потенциала.
По результатам анализа модифицированных пептидов по различным остаткам строится кластерное дерево.
Протокол молекулярной динамики
- Потенциальное поле: Amber99.
- Длина траектории: 10 нс.
- Температура: 2000 К.
- Термостаты: Берендсена и столкновительный.
- Термостаты: Берендсена и столкновительный.
- Постоянная времени в термостате Берендсена: 0.5 пс.
- Масса виртуальной частицы в столкновительном термостате: 18 а.е.м.
- Частота столкновения виртуальных частиц с атомами в расчитываемой системе в столкновительном термостате: 55 пс–1.
- Диэлектрическая проницаемость среды: ε = 1.
- Радиус обрезания для кулоновского взаимодействия: Rel = 21 Å.
- Радиус обрезания для взаимодествия Ван-дер-Ваальса: RVdW = 16,8 Å.
- Использовалась кубическая периодическая ячейка размером 100х100х100 Å3.
- Шаг интегрирования: δ = 1 фс.
- Шаг записи в траекторный файл: 0.1 пс.
- Шаг записи в файл статистики: 1 фс.
- Для численного интегрирования использовался алгоритм Верле.
- Начальные скорости задавались в соответствии с распределением Максвелла с помощью генератора случайных чисел.
Результаты и обсуждение
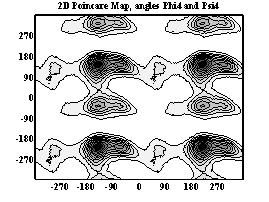
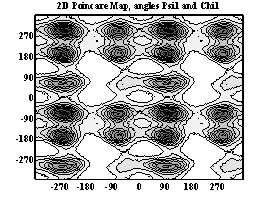
Двумерные карты распределения плотностей вероятности для углов φ и ψ в аминокислотных остатках.
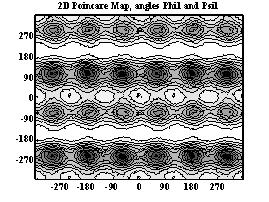
Метионин
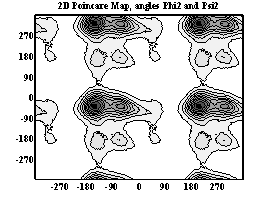
Аспарагиновая к-та

Гистидин
Фенилаланин
При анализе двумерных карт распределения плотностей вероятности в данном случае выявляется следующее:
- метионин имеет несколько локальных минимумов и более подвижен, так как является концевым остатком.
- аспарагиновая к-та имеет два локальных минимума, из которых один соответствует правой π-спирали, второй – правой α-спирали, наиболее вероятна правая α-спираль.
- гистидин имеет пять энергетических минимумов. Самый глубокий минимум на карте (–120; 0) не соответствует какой-либо стандартной вторичной структуре. Наиболее вероятными конформациями являются: антипараллельная β структура (–120; 120) и левая 310 спираль (60; 30).
- фенилаланин имеет 5 энергетических минимумов, среди которых минимумы (120; 45), (–60; –45), (70; 120), (–60; 120) не соответствуют какой-либо стандартной вторичной структуре. Наиболее вероятна антипараллельная β-конформация, соответствующая минимуму (–120; 120).
Двумерные карты распределения плотностей вероятности для углов ψ и χ в аминокислотных остатках.
Метионин
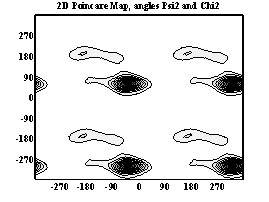
Аспарагиновая к-та
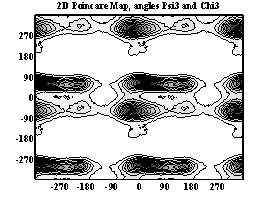
Гистидин
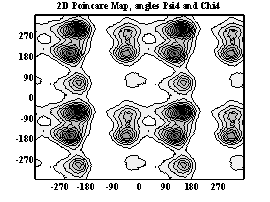
Фенилаланин
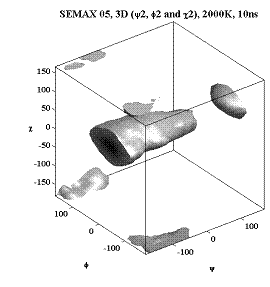
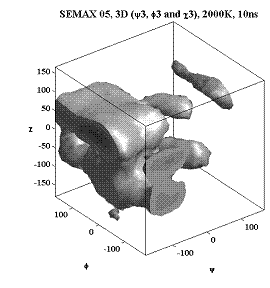
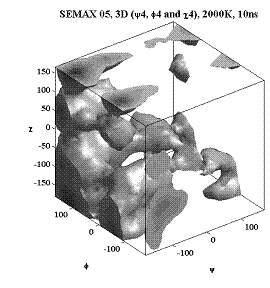
Трёхмерные карты распр. плотностей вер. для углов φ, ψ и χ.
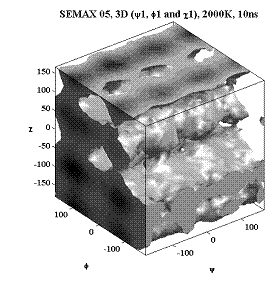
Метионин
Аспарагиновая к-та
Гистидин
Фенилаланин
Кросскорреляционные функции.
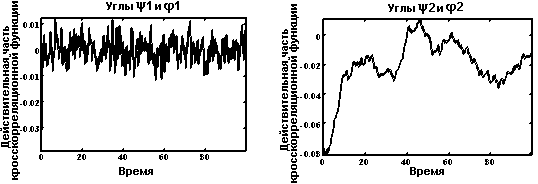
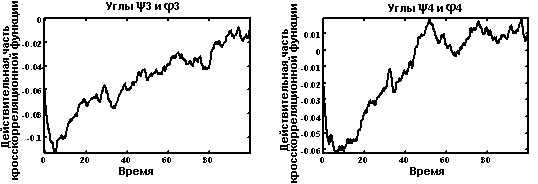
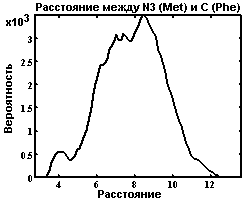
Функция расстояния между метионином и фенилаланином.
Автокорреляционная функция для углов φ, ψ и χ.
Автокорреляционные функции для углов φ, ψ и χ в остатках Met-Asp-His-Phe (нумерация остатков проводится с N-конца пептида).
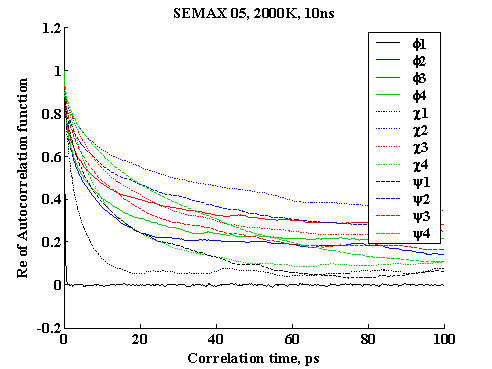
На графике наблюдаются несколько типов зависимостей для автокорреляционных функций. Так, например, автокорреляционая функция, характеризующая динамику
- угла φ метионина (самый нижний график) отражает ситуацию, связанную с наибольшей свободой вращения, что обусловлено концевым положением остатка метионина;
- угла ψ гистидина (график над предыдущим) отражает большую зажатость данного угла по сравнению с предыдущим случаем;
- угла ψ фенилаланина (самый верхний график) отражает ситуацию, в которой вращение сильно затрудненно, что обусловлено положением остатка в середине пептидной цепи.
Одномерный дисперсионный анализ автокорреляционных функций углов ψ в ряде модификаций семакса.
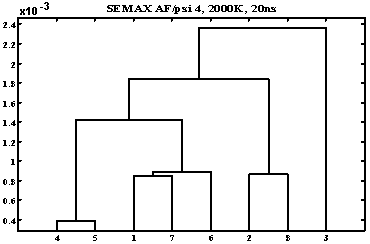
- семакс01 (Met Glu His Phe:)
- семакс02 (Met Glu His Phe-D:)
- семакс05 (Met Asp His Phe:)
- семакс09 (Cys Glu His Phe:)
- семакс13 (Phe-D His Glu Met:)
- семакс15 (Phe His Glu Met:)
- семакс17 (Gly Glu His Phe:)
- семакс18 (Lys Glu His Phe:)
На графике наблюдаются три типа поведения всех углов (граница сечения – 1,5 10–3). Можно отметить, что замена одного остатка – во втором положении Glu на Asp – больше всего влияет на свойства пептида по сравнению с заменами других остатков.